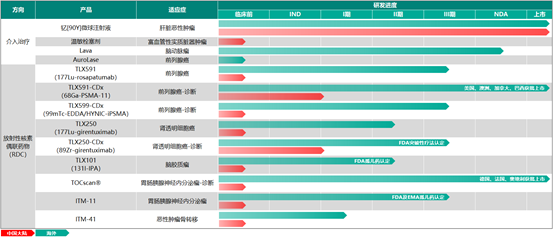
昨日,远大制药发布公告称,其在放射性核素偶联药物领域用于前列腺癌诊断的新药TLX591—CDx的临床试验申请已于最近几天获得国家美国食品药品监督管理局批准。
公告称,TLX591—CDx是全球创新的基于放射性核素—小分子偶联技术的靶向前列腺特异性膜抗原的诊断用放射性药物,适用于转移性前列腺癌和复发性前列腺癌的诊断。
根据消息显示,远大制药在中国提交的IND申请是TLX591—CDx在中国人群中的三期临床桥接研究,将在100多例患者中使用,以评估该产品对前列腺癌生化复发患者的诊断有效性,以及该产品在中国人群中的安全性和耐受性,从而为该产品在中国上市提供支持。
TLX591—CDx于2021年11月获准在澳大利亚上市,同年12月在美国上市,并在正式获批前在巴西获得特别授权销售今年10月获准在加拿大上市,目前也已在16个国家提交上市申请TLX591—CDx在美国上市后,销售收入增长超出预期第二季度该产品全球销售收入达到约2250万澳元,环比增长超过10倍
在临床研究中,TLX591—CDx于2022年2月在日本完成了涉及10名受试者的I期试验结果表明,TLX591—CDx是安全的,耐受性良好,在所有受试者中未观察到严重的不良事件全身和器官特异性辐射剂量测定和药代动力学数据显示,日本人和西方人之间没有显著差异
最近几年来,远大制药不断发力,深化核医学抗肿瘤诊疗板块布局TLX591—CDx国产IND获批是公司核医学抗肿瘤诊疗平台在国内的又一重要进展,未来有望填补国内前列腺癌诊断的临床需求
关键词:
郑重声明:此文内容为本网站转载企业宣传资讯,目的在于传播更多信息,与本站立场无关。仅供读者参考,并请自行核实相关内容。